- +39 049 830 52 22
- +39 335 10 37 802
- info@protec-protezionecatodica.it
- Mon - Fri 8:00 - 18:30
Impianti di protezione catodica
La corrosione dei metalli è un fenomeno chimico-fisico che avviene con degradaione di uno o più metalli in contatto con un certo ambiente e che comporta la presenza simultanea di due areazioni: una anodica con ossidazione e una catodica di riduzione dell'ossigeno.

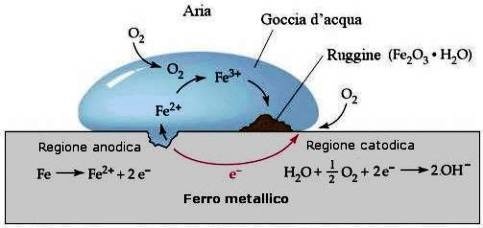
Quando un metallo è a contatto con un elettrolita (acqua, terreno, umidità, ecc.) assume un potenziale elettrico determinato dalle reazioni chimiche citate ed il cui valore dipende dal metallo e dall'elettrolita. Due metalli diversi a contatto elettrico fra loro e immersi in un elettrolita, assumendo due diversi valori di potanziale, provocano il flusso di una corrente elettrica spontanea che tende a condurre i potenziali naturali dei metalli verso uno stesso valore detto potenziale di corrosione o misto. La circolazione di corrente nel metallo avviene a livello elettronico, mentre nell'elettrolita avviene mediante migrazione ionica connessa con le reazioni di ossidoriduzione e pertanto con disgregazione del mantello il cui potenziale è più anodico.

Fornendo alla coppia di metalli presa in considerazione al punto precedente una corrente elettrica esterna, provochiamo una variazione del potenziale misto introducendo forzatamente una sovratensione. E' dimostrabile che, se questa sovratensione è tale da provocare una diminuzione del potenziale misto fino ad un valore inferiore al potenziale del metallo più anodico, no può più avvenire la reazione di corrosione.

Su questo concetto scoperto nel 1824 da Humpry Davy si basa la protezione catodica, che consiste appunto nel rendere la superficie di un metallo da proteggere più elettronegativa di quello che è il suo potenziale di ossidoriduzione in un determinato elettrolita. Naturalmente la corrente deve essere fornita realizzando un circuito in grado di far circolare la corrente nell'elettrolita con scambio ionico alimentato da una reazione di ossidazione. In altre parole, non sarà sufficiente disporre di un generatore di corrente elettrica continua, ma sarà necessario inserire nel circuito anche un elemento sacrificabile su cui possa avvenire la reazione di ossidazione.
Alcune attività svolte relativamente agli impianti di protezione catodica:
- Stesura e insuflaggio cavi;
- Posa elettrodi;
- Posa dispersori orizzontali;
- Posa dispersori verticali;
- Montaggio impianti di alimentazione;
- Montaggio impianti di drenaggio;
- Rilievi geo-elettrici;
- Registrazioni elettriche e collaudi degli stati elettrici;
- Bilanciamento impianti;
- Posa di armadi porta apparecchiature;
- Montaggio impianti di fornitura di energia elettrica da rete e solari;
- Attività di manutenzione programmata e straordinaria;
per maggiori informazioni contatta Pro.Tec Srl o chiamaci.

Informazioni di contatto
- Sede Operativa: Via Giuseppe Mazzini, n. 159 Sarmeola, PD 35030
- Sede Legale: Via Angelo Candeo n. 53 Mestrino, PD 35035 IT
- P.iva 04050640285
- Tel. +39 049 830 52 22
- Mobile +39 335 10 37 802
- info@protec-protezionecatodica.it
- Pec: pro_tec@itapec.eu
